Cytomegalowirus
| Cytomegalia | |||||||||||||
|
|||||||||||||
| Cytomegalowirus | |
| Systematyka | |
| Rodzina | Herpesviridae |
| Cechy wiralne | |
| Skrót | CMV, HCMV, HHV-5 |
| Kwas nukleinowy | DNA |
| Liczba nici | ds |
| Liczba segmentów | jeden |
| Osłonka | ikozaedralna |
| Nagi kwas nukleinowy | zakaźny |
| Rezerwuar | człowiek |
| Wywoływane choroby | cytomegalia |
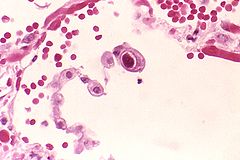
Cytomegalowirusowa infekcja pneumocytów płucnych.
Cytomegalowirus (CMV, HCMV) – zwyczajowa nazwa należącego do podrodziny Betaherpesvirinaeherpeswirusa HHV-5 (human herpesvirus-5)[1]. Nazwą tą określa się też niektóre inne wirusy z podrodziny Betaherpesvirinae nieatakujące ludzi.
CMV atakuje zwłaszcza gruczoły ślinowe, a także może być wyniszczający lub nawet śmiertelny dla płodów. Infekcja CMV może być zagrożeniem dla życia ludzi o upośledzonej odporności (przykładowo osób z AIDS lub biorców przeszczepów)[1]. Wirusy CMV można znaleźć u wielu gatunków ssaków i generalnie są one specyficzne tylko dla nich.
Gatunki
Cytomegalowirusami nazywane są:
- Cercopithecine herpesvirus 5 (CeHV-5) – cytomegalowirus afrykańskiej zielonej małpy
- Cercopithecine herpesvirus 8 (CeHV-8) – cytomegalowirus rezusów
- Human herpesvirus 5 (HHV-5) – ludzki cytomegalowirus
- Pongine herpesvirus 4 (PoHV-4) – cytomegalowirus orangutanów
Gatunki poddane pod dyskusję:
- Aotine herpesvirus 1 (AoHV-1)
- Aotine herpesvirus 3 (AoHV-3).
Ogólne informacje
Cytomegalowirus (CMV) występuje powszechnie na wszystkich szerokościach geograficznych, wśród wszystkich grup socjoekonomicznych – w USA przykładowo zakażonych jest 50-85% ludzi w wieku 40 lat. CMV jest także wirusem najczęściej przenoszonym na płód. Infekcja CMV występuje częściej w krajach rozwijających się oraz na obszarach o obniżonych warunkach socjoekonomicznych. U większości zdrowych ludzi, którzy ulegają zakażeniu CMV po urodzeniu, występują łagodne objawy, i nie rozwijają się powikłania. Niektóre osoby z przebiegiem objawowym zakażenia doświadczają zakaźnejmononukleozy z przedłużoną gorączką oraz łagodnego zapalenia wątroby (hepatitis). Bardzo obolałe gardło jest także powszechne. Gdy człowiek raz przejdzie zakażenie, wirus pozostaje żywy w organizmie, ale zazwyczaj w uśpieniu do końca życia. Nawrót choroby jest rzadki, chyba że układ odpornościowy nosiciela ulegnie supresji pod wpływem terapii lekowej lub choroby. Z tego powodu dla ogromnej większości ludzi zakażenie CMV nie jest poważnym problemem.
Zakażenie CMV jest jednakże ważne dla pewnych grup ryzyka: (1) płód w czasie ciąży, (2) osoby pracujace z dziećmi (3) osoby z upośledzoną lub obniżoną odpornością, tacy jak zakażeni wirusem HIV i biorcy narządów.
W wyniku działania wirusa apoptoza komórki nosiciela zostaje zahamowana i dochodzi do masywnego powiększenia tejże komórki (stąd nazwa wirusa).
Charakterystyka wirusa
CMV jest członkiem rodziny herpes, do której należą również wirusy herpes simplex1 i 2, ospy wietrznej–półpaśca, Epsteina-Barr (który wywołuje mononukleozę zakaźną). Wszystkie te wirusy posiadają zdolność do pozostawania w organizmie w stanie latentnym przez bardzo długi czas.
Początkowe zakażenie CMV, które może dawać niewiele objawów, zazwyczaj pociąga za sobą przedłużone, bezobjawowe zakażenie, w czasie którego wirus przebywa w komórkach nie czyniąc wykrywalnych uszkodzeń czy klinicznych symptomów choroby. Poważne osłabienie układu immunologicznego organizmu przez stosowane leki lub choroby (zobacz poniżej) może reaktywować wirusa ze stanu latentnego lub uśpionego.
Cytomegalowirus może się rozprzestrzeniać w płynach ciała każdej poprzednio zakażone osoby i stąd można go znaleźć w moczu, ślinie, spermie, łzach, krwi i mleku kobiecym. Rozprzestrzenianie się wirusa może mieć miejsce z przerwami, bez jakichkolwiek wykrywalnych oznak i bez występujących objawów.
W rezultacie starań o stworzenie szczepionki z atenuowanym CMV, wydzielono dwie klasy tego wirusa. Klinicznie wyizolowana klasa zawiera wirusy zdobyte od pacjentów i reprezentuje dziki typ genomu wiralnego, podczas gdy laboratoryjne szczepy były intensywnie hodowane w warunkach laboratoryjnych i typowo zawierają liczne skumulowane mutacje.
Cytomegalowirus (CMV) oddziałuje na produkcję czynnika wzrostu śródbłonka naczyniowego VEGF (vascular endothelial growth factor), białka sygnalizacyjnego, które bierze udział w angiogenezie. Wysiękowe zwyrodnienie plamki żółtej oka wywołane jest zakażeniem oczu cytomegalowirusem.
Zakażenie płodu i noworodków
Wirus jest główną przyczyną wrodzonych zakażeń noworodków, a także najczęstszą zakaźną przyczyną upośledzeń umysłowych, głuchoty i wielu innych wad rozwojowych.
Szacuje się, że zakażenie wirusem CMV dotyczy 1% noworodków. Mogą one ulec zakażeniu różnymi drogami:
- Przez łożysko (zakażenie wrodzone) u matek, które uległy zakażeniu przed porodem
- Po przetoczeniu noworodkowi krwi zakażonej wirusem CMV
- Przez kontakt z kanałem rodnym zakażonej matki w czasie porodu (zakażenie okołoporodowe)
- Po urodzeniu, wraz z mlekiem matki.
Do powikłań zakażenia noworodków wirusem CMV, które mogą się ewentualnie rozwinąć, należą: uogólnione zakażenie (czasami śmiertelne) z powiększeniem wątroby i śledziony (hepatosplenomegalia) i żółtaczką, trombocytopenia, niedokrwistość hemolityczna, wysypka, utrata słuchu, zapalenie naczyniówki i siatkówki, a także zanik nerwu wzrokowego (w wyniku czego może dojść do osłabienia widzenia), zapalenie wątroby, płuc, opóźnienie umysłowe różnego stopnia, problemy z równowagą, mikrocefalia, zwapnienia okołokomorowe, wylewy wewnątrzczaszkowe.
Pacjenci z obniżoną odpornością
Pierwotne (albo inaczej pierwsze) zakażenie wirusem cytomegalii u osób z obniżoną odpornością może spowodować chorobę o poważnym przebiegu. Największym jednak problemem jest reaktywacja zakażenia latentnego.
U pacjentów z supresją układu odpornościowego choroba wywołana przez CMV może mieć znacznie agresywniejszy przebieg. Cytomegalowirusowe zapalenie wątroby może spowodować piorunującą niewydolność wątroby. Specyficzne jednostki chorobowe u takich ludzi, to: cytomegalowirusowe zapalenie siatkówki (retinitis charakteryzujące się obrazem ciasta do pizzy w oftalmoskopii), jagodówki, wątroby oraz cytomegalowirusowe zapalenie jelita grubego (colitis).
Zakażenie CMV jest główną przyczyną śmierci u pacjentów z obniżoną odpornością, wliczając tu biorców przeszczepów, osób poddawanych hemodializie, osób z chorobą nowotworową, pacjentów z zastosowaną terapią immunosupresyjną oraz zakażonych HIV. Z powodu tego ryzyka wystawienie pacjentów z obniżoną odpornością na zewnętrzne źródła cytomegalowirusa powinno być zminimalizowane. Gdy tylko to możliwe, pacjenci bez zakażenia CMV powinni otrzymywać narządy lub krew, które są wolne od tego wirusa.
Pacjenci bez infekcji CMV, którzy otrzymują przeszczepiane narządy od dawców zakażonych CMV, powinni otrzymywać profilaktyczną terapię z walgancyklowirem (najlepiej) lub gancyklowirem i wymagają regularnego monitorowania serologicznego dla wykrycia podnoszącego się miana przeciwciał dla CMV, które powinno być leczone możliwie najwcześniej dla zapobieżenia rozwinięcia się zakażenia zagrażającego życiu.
Leczenie
Żadne konkretne leczenie nie jest ogólnie wymagane na zakażenie CMV u pacjentów z normalną odpornością, ponieważ organizm sam potrafi sobie poradzić z takim zakażeniem. Obecnie ocenia się możliwość zastosowania leczenia przeciwwirusowego u noworodków.
Leczenie gancyklowirem stosuje się u pacjentów z obniżoną odpornością, u których choroba jest związana z narządem wzroku lub zagraża życiu. Walgancyklowir (prolek gancyklowiru) jest lekiem przeciwwirusowym, który także działa skutecznie i jest przyjmowany doustnie. Foskarnet może być podawany pacjentom z CMV opornym na gancyklowir, chociaż jest gorzej tolerowany niż gancyklowir.
Szczepionki są nadal w stadium badań i opracowywania.
Przypisy
- Ryan KJ, Ray CG (editors): Sherris Medical Microbiology. Wyd. 4th ed.. McGraw Hill, 2004, s. pp. 556; 566–9. ISBN 0838585299.
- Skocz do góry ↑ Cytomegalia
Wirus CMV (HHV-5)
Wirus CMV (HHV-5) powoduje cytomegalię. Powszechnie występuje w populacji ludzkiej (jest on obecny u 60–100%). Zazwyczaj dochodzi do bezobjawowego zakażenia jeszcze w dzieciństwie, a tylko u około 10% osób mogą się pojawiać objawy grypopodobne, powiększenie węzłów chłonnych, wątroby, śledziony. U osób z obniżoną odpornością może dojść do ciężkich zakażeń z zapaleniem płuc, mózgu, wątroby. Wirus cytomegalii jest jednym z ważniejszych zagrożeń dla biorców przeszczepów, dlatego w transplantologii stosowana jest często profilaktyka lekami przeciwwirusowymi. Po przebytym zakażeniu wirus pozostaje w organizmie w formie utajonej i może przy spadku odporności wywołać powtórne zakażenie.
W przypadku kobiet ciężarnych może dojść do reaktywacji już obecnego wirusa, a także do zakażenia pierwotnego. O wiele groźniejsza jest druga sytuacja, ponieważ w pierwszym przypadku przeciwciała matczyne chronią w pewnym stopniu płód – w przypadku reaktywacji ryzyko zakażenia płodu to 1%, a w przypadku zakażenia pierwotnego nawet do 40%.
Cytomegalia wrodzona w pierwszym trymestrze ciąży zwykle wiąże się z ciężką wadą wrodzoną (głównie w obrębie ośrodkowego układu nerwowego) lub nawet poronieniem. Przy zakażeniu w drugim trymestrze ciąży dochodzi do zakażenia centralnego układu nerwowego prowadzącego do wystąpienia triady objawów:
- małogłowie,
- zmiany dna oka,
- zwapnienia wewnątrzmózgowe.
Zakażenie w ostatnim trymetrze ciąży może prowadzić do porodu przedwczesnego, a przede wszystkim do ciężkiego zakażenia u noworodka.
Diagnostyka polega na wykrywaniu przeciwciał i DNA wirusa (szczególnie ważna u kobiet w ciąży). Lekiem pierwszego rzutu jest gancyklowir (lub jego pochodna walgancyklowir) – jeśli nie jest skuteczny to podajemy cydofowir i foskarnet. Leki te mogą być zastosowane u noworodków z ciężkim zakażeniem, ale nie są zalecane do stosowania u kobiet ciężarnych (chyba że istnieje poważne zagrożenie dla płodu).
Nie ma dostępnej szczepionki (jest dopiero w fazie badań klinicznych). W przypadku kobiet w ciąży (szczególnie tych, które nie mają przeciwciał przeciw wirusowi) należy regularnie badać poziom DNA wirusa w celu uchwycenie początku zakażenia i aby rozpocząć ewentualne leczenie lub podanie przeciwciał.