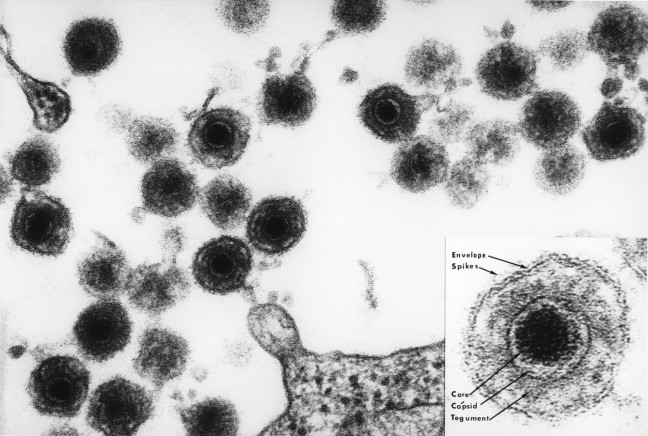
HHV-6
Zakażenia wirusem herpes typ 6 (HHV-6)
Rola wirusa HHV-6 w stwardnieniu rozsianym
Czy zwykły wirus może wywołać SM?
Badacze na całym świecie od lat zadają sobie to pytanie. W ostatnich miesiącach pojawiło się więcej dowodów na to, że odpowiedź może brzmieć „tak”.
W wielu laboratoriach, zwłaszcza w Narodowym Instytucie Zdrowia USA, badacze znaleźli dowody na to, że ludzki wirus HHV-6 (human herpes virus – 6) znajdowany jest w tkance nerwowej ludzi.
Jeżeli odpowiedź brzmi „tak”, stwarza to możliwości zastosowania istniejących leków antywirusowych w leczeniu SM.
Obecnie przeprowadzane są małe próby kliniczne nad zastosowaniem w leczeniu SM leków antywirusowych stosowanych w leczeniu zakażeń wywołanych wirusem herpes. W USA i Danii prowadzone są próby kliniczne nad zastosowaniem Valtrexu w przypadku leczenia SM. Valtrex (Valacyclovir) jest lekiem antywirusowym z grupy acyklowiru.
Wiadomo, że HHV-6 wywołuje różyczkę, częstą chorobę wieku dziecięcego. 90% dorosłej populacji było narażone na to zakażenie w dzieciństwie. Pierwszy raport wykazujący związek pomiędzy zakażeniem HHV-6 i występowaniem SM pojawił się w 1995 roku, kiedy badacze z Seattle opisali, że w niektórych ogniskach demielinizacji w mózgu oraz w komórkach nerwowych pacjentów chorych na SM znaleźli DNA wirusa HHV-6. Najważniejszą obserwacją było znalezienie DNA tego wirusa w oligodendrocytach – komórkach, które wytwarzają mielinę i które są celem ataków układu immunologicznego w stwardnieniu rozsianym. Nie znaleziono DNA wirusa HHV-6 w oligodendrocytach osób nie chorujących na SM. Badania te zostały potwierdzone w Belgii i USA (Nowy Jork), gdzie również znaleziono dowody na obecność HHV-6 w tkankach osób chorych na SM.
„Dawno już wysuwano podejrzenie etiologii wirusowej w przypadku stwardnienia rozsianego, co tłumaczyłoby niektóre dziwne cechy tej choroby” – powiedział dr Rice, naukowiec zajmujący się SM w Western Ontario University. Sporadycznie występowały epidemie SM (Wyspy Faroe), zadziwia niezupełna zgodność występowania tej choroby u identycznych bliźniąt – tylko u 30% tych bliźniąt SM występuje u obojga z nich, badania nad migracją ludności wykazują, że czynniki, które działają w pierwszych 15 latach życia mają wpływ na ryzyko zachorowania.
Być może rozwój SM można wytłumaczyć występowaniem różnej kombinacji czynników. „Można podejrzewać, że jedynie mała grupa osobników jest genetycznie wrażliwa na wirusa. Jeżeli za SM odpowiedzialny jest wirus HHV-6, musimy również wiedzieć, dlaczego zakażenie tak rozpowszechnionym wirusem wywołuje chorobę u tak niewielu osób” – powiedział dr Steven Jacobson z Narodowego Instytutu Zdrowia.
Obecnie największą uwagę przywiązuje się do HHV-6, ale badania prowadzone są także nad innymi wirusami włączając w to coronavirus (wywołuje zakażenia dróg oddechowych) – dr Pierre Talbot w Laval i wirus opryszczki herpes simplex – dr Kastrukoff, University B. C.
 W czasie naszego wczesnego dzieciństwa większość z nas wpuszcza do swojego organizmu pasażerów na gapę, którzy pozostają z nami na zawsze. Mogą oni pojawiać się, gdy mamy słabsze dni, a także wkręcić się w nasze drzewo genealogiczne i zamieszkać w genach dzieci lub wnuków. Wirus ten nazywa się wirusem opryszczki ludzkiej 6, w skrócie HHV-6. Znajduje się on prawdopodobnie również w twoim genomie. Jak sama nazwa wskazuje, HHV-6 jest jednym z wirusów opryszczki. W przeciwieństwie do innych członków rodziny, ten nie powoduje opryszczki, ale jest jedną z najpowszechniejszych infekcji na Zachodzie. Znajduje się w ciałach ponad 90% dzieci i powoduje powszechną chorobę zwaną „rumieniem nagłym”, także roseola lub gorączka trzydniowa. Objawy infekcji szybko nikną, ale wirus pozostaje.
W czasie naszego wczesnego dzieciństwa większość z nas wpuszcza do swojego organizmu pasażerów na gapę, którzy pozostają z nami na zawsze. Mogą oni pojawiać się, gdy mamy słabsze dni, a także wkręcić się w nasze drzewo genealogiczne i zamieszkać w genach dzieci lub wnuków. Wirus ten nazywa się wirusem opryszczki ludzkiej 6, w skrócie HHV-6. Znajduje się on prawdopodobnie również w twoim genomie. Jak sama nazwa wskazuje, HHV-6 jest jednym z wirusów opryszczki. W przeciwieństwie do innych członków rodziny, ten nie powoduje opryszczki, ale jest jedną z najpowszechniejszych infekcji na Zachodzie. Znajduje się w ciałach ponad 90% dzieci i powoduje powszechną chorobę zwaną „rumieniem nagłym”, także roseola lub gorączka trzydniowa. Objawy infekcji szybko nikną, ale wirus pozostaje.
Podobnie jak inne wirusy opryszczki, HHV-6 może wejść w fazę uśpienia zwaną „utajeniem”, pozostając w naszych komórkach po ustąpieniu objawów pierwszej infekcji. Ci pasażerowie na gapę mogą pozostać z nami przez całe życie, a czasami mogą zostać użyci ponownie do zarażania, w szczególności, gdy system odpornościowy gospodarza zostanie osłabiony. Na przykład pacjenci z HIV cierpią z powodu nawracających infekcji. Po dziesięcioleciach bezobjawowego uśpienia, przebudzenie HHV-6 może być poważne i osłabiające.
Obecnie Jesse Arbuckle ze Szkoły Medycznej Uniwersytetu Południowej Florydy odkrył miejsce ukrywania się wirusa. Większość wirusów opryszczki pozostawia po prostu swój genom, jako pierścień DNA unoszący się w zainfekowanych komórkach. HHV-6 jest bardziej przebiegłym penetratorem. Wkopuje on swoje geny w genom nosiciela celując w specjalne struktury zwane telomerami, które znajdują się na końcu naszych chromosomów. Telomery są jak plastikowe metki na końcu sznurowadeł w naszych butach — zabezpieczają długie nici DNA przed wystrzępianiem się, utratą ważnych informacji oraz poplątaniem się.
Arbuckle pracował z czterema rodzinami, w których przynajmniej dwa pokolenia miały ponadprzeciętnie wysoki poziom HHV-6 we krwi. Niektórzy nie mieli żadnych objawów, a inni mieli problemy neurologiczne. Arbuckle przetestował ich białe krwinki i rozpoczął poszukiwania HHV-6 używając świecących w ciemności cząsteczek stworzonych do rozpoznawania DNA wirusa. Gdy rozpoczął poszukiwania świecących kropek pod mikroskopem, dostrzegł, że każda z nich usadowiła się na końcach chromosomów pacjentów i nigdzie indziej (zobacz poniżej). W oczywisty sposób wirus specjalizuje się we włamaniach do telomerów.
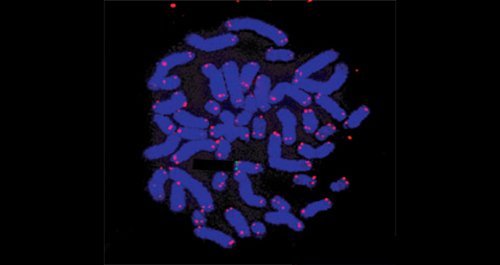
Czyni to używając trochę genetycznej mimikry. Telomery są niesamowicie monotonne i ludzkie zawierają powtarzaną w kółko sekwencję TTAGGG. Przypadkiem HHV-6 ma dokładnie taką samą sekwencję w swoim genomie czyniąc łatwiejszym przenikanie do sekwencji w naszym genomie.
W stanie utajonym HHV-6 może poczekać do momentu aż warunki są odpowiednie do obudzenia. Arbuckle udało się wywołać jego obudzenie używając środka chemicznego zwanego trychostatyna A (TSA), która reaktywuje także inne uśpione wirusy opryszczki. Hodując komórki od swoich zainfekowanych rodzin, odkrył, że dawka TSA prowadzi do wzrostu poziomu wirusowego DNA. Utajone geny HHV-6 mogły produkować nowe wirusy zdolne do wywołania infekcji.
Odnalezienie kryjówki HHV-6 jest ważnym odkryciem, ale wciąż pozostaje wiele pytań bez odpowiedzi. Co powoduje, że przenosi on swoje geny do telomerów, zamiast kontynuować swój normalny cykl infekcyjny gdy wirus po raz pierwszy atakuje nosiciela? Co jest naturalnym powodem jego reaktywacji, gdy już jest w organizmie? I czy obecność owych wirusowych pasażerów na gapę wpływa na telomery? Ostatnie pytanie jest szczególnie ważne — telomery są bardzo istotne dla ochrony naszego DNA przed uszkodzeniami podobnie jak problemy z telomerami są związane z rakiem oraz upośledzeniem umysłowym.
Konsekwencje infekcji HHV-6 stają się nawet większe, gdy weźmiemy pod uwagę to, że wirus może przenosić się z rodzica na dziecko. Arbuckle wykazał, że członkowie rodziny z utajonym HHV-6 nosili te same sekwencje wirusowe w swoich telomerach. Oznacza to, że jak tylko wirus znajdzie swoją drogę do czyjegoś genomu, może stać się genetyczną pamiątką mimowolnie przenoszoną z rodzica na dziecko. Czy dziecko dziedziczy również ryzyko choroby uwzględniając fakt, że wirus może się ujawnić w każdej chwili? Wreszcie, czy ich system odpornościowy otrzymuje ochronę przed innymi wirusami opryszczki uwzględniając fakt, że miały one doświadczenie z wirusami od samych urodzin? Tylko czas i dodatkowe badania odpowiedzą na te pytania.
Źródła: Arbuckle, J., Medveczky, M., Luka, J., Hadley, S., Luegmayr, A., Ablashi, D., Lund, T., Tolar, J., De Meirleir, K., Montoya, J., Komaroff, A., Ambros, P., & Medveczky, P. (2010). The latent human herpesvirus-6A genome specifically integrates in telomeres of human chromosomes in vivo and in vitro, Proceedings of the National Academy of Sciences, 107 (12)10.1073/pnas.0913586107